*Team-NB • ISO 10993-18 • Notifications • Stats & Diag • Jeu-Concours
Update: 2020-01-25
Description
Actu. du DM : semaine du 20 janvier 2020
Grand Jeu Concours Qualitiso : gagnez votre poids en abonnement illimité !
Europe
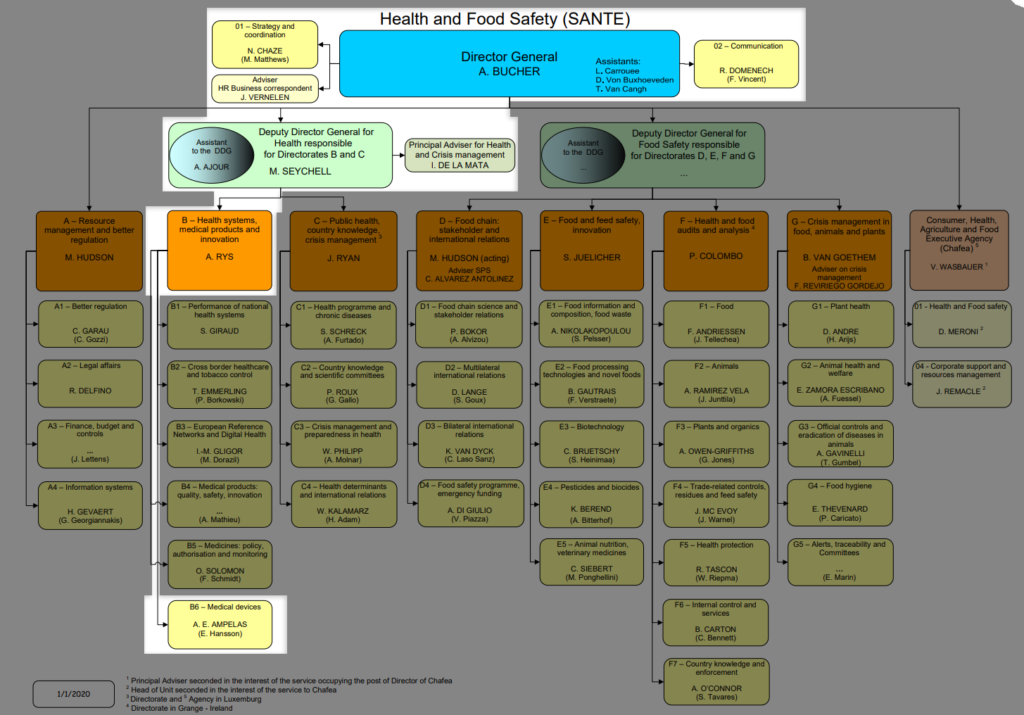
- DG SANTE accueille les dispositifs médicaux
- Un point sur les notifications – article de veille
- Le planning 2020 du MDCG
- EMA : 10 recommandations pour le big data en santé
- Team-NB :
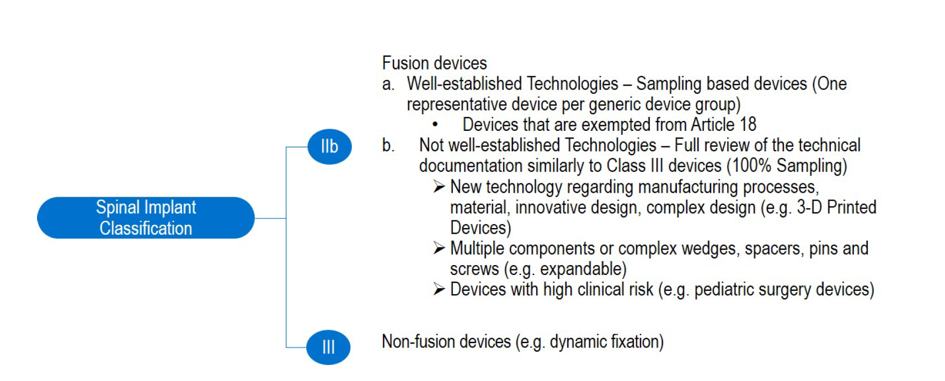
- Joint NB Position Paper on Spinal Classification per the MDR
- Code de conduite des ON : la V4, compatible règlement
- Medtech Europe : révision du doc sur les symboles pour le RDM
France
- Enfin des insides du GMED
- HAS : Contribuer à l’évaluation des dispositifs médicaux
- Loi de finances 2020 : taxe DM, clause de sauvegarde – article de veille
Suisse
- Information for all Swiss manufacturers of medical devices Third country compliance for all products (MDR and MDD) from 26 May 2020 is currently the realistic «worst case scenario» / La Suisse avertit l’UE de ne pas jouer avec la sécurité des malades
Monde
- FDA :
- Nouveau module CDRH learn : PMS
- Radiologie :
- Reclassification des analyseurs d’images
- Classification des logiciels de diagnostic radiologique pour les lésions suspectes de cancer
- Classification des logiciels de triage et de notification radiologique assisté par ordinateur
- Évaluation de la performance clinique : Considérations relatives aux logiciels d’assistance à la détection en radiologie – Notification préalable à la mise sur le marché (510(k))
Normes
- Publications :
- ISO 10993-18:20 20 – Évaluation biologique des dispositifs médicaux — Partie 18: Caractérisation chimique des matériaux des dispositifs médicaux au sein d’un processus de gestion du risque – article de veille
- ISO 14971:20 19 – Application de la gestion des risques aux dispositifs médicaux – comment sont fixés les prix des normes
- Mais aussi : NF EN ISO 10555-6/A1, NF EN ISO 10555-6/A1, ISO 16202-1 et ISO 16202-2, NF EN IEC 80601-2-49 … voir le flux de veille normative
- Enquêtes :
- PR NF EN ISO 14708-5 – Implants chirurgicaux – Dispositifs médicaux implantables actifs – Partie 5 : Dispositifs d’assistance circulatoire
Focus : DM de diagnostic et probas
Bonus
- Pourquoi sommes-nous plus heureux ensemble ?
Notes
DG-SANTÉ : DM
Planning MDCG
- planif post 36 mai : normes, ON, SAV et vigilance, IUD, nouvelles technologies
- grandes vacances : 6 juillet au 1ᵉʳ septembre
- fin de l’année : 14 octobre
- 31 jours / 253 = 12% des jours ouvrés
Team-NB : Position paper
Déjà connu depuis quelques temps
Donne la position de la team NB sur la règle 8 de la nouvelle classification :
s’il s’agit de prothèses discales ou de dispositifs implantables entrant en contact avec la colonne vertébrale, auxquels cas ils relèvent de la classe III, à l’exception des composants tels que les vis, les cales, les plaques et les instruments
- La règle utilise des termes génériques ou pire, fait appel à des termes qui ne sont pas retrouvés dans la pratique chirurgicale (wedge)
- La règle n’est pas exhaustive et laisse la place à l’interprétation (such as)
En résumé :
- technologie connue = on évite les contraintes inutiles.
- Nouvelles technologies = on verrouille.
Vu que ça vient de team NB, qui intègre la majorité des NB sérieux, y a de grande chance de voir cela appliqué
Ils recommandent également une application plus modérée de l’article 54 pour cette classe de DM, en limitant le recours à l’article 54.
Team-NB : Code Of Conduct
- Les ON doivent déterminer la durée de l’audit pour l’audit initial de l’étape 1 et de l’étape 2, les audits de surveillance et les audits de re-certification pour chaque demandeur et client certifié. Cette partie du document ne stipule pas de délais minimum/maximum mais fournit un cadre qui doit être utilisé dans le cadre des procédures documentées de l’ON pour déterminer la durée appropriée de l’audit
- La base de calcul du temps d’audit requis est le tableau de l’annexe D du MD9:20 17 de l’IAF
- Au moins 80 % du temps minimum d’audit tel que spécifié dans le document IAF MD9:20 17 doit être passé sur place
- Le temps d’audit ne peut être réduit par des techniques d’audit à distance telles que la collaboration interactive sur le web, les réunions sur le web, les téléconférences et/ou la vérification électronique des processus du client
- Les audits inopinés sont des audits axés sur les produits. Tous les éléments contrôlés sont orientés vers le(s) dispositif(s) échantillonné(s).
- Si le fabricant a sous-traité une ou plusieurs parties critiques de la fabrication soit à ses propres sites de fabrication, soit à des fournisseurs, et que ces parties sont considérées comme importantes pour la sécurité et les performances du dispositif examiné, l’organisme notifié doit alors déterminer si ces sites doivent être audités dans le cadre de l’audit inopiné.
- En outre, il existe de nombreux documents d’orientation et normes qui s’appliquent aux travaux des organismes notifiés dans la pratique. Ils sont émis par la Commission européenne : MEDDEV, MDCG, IAF, NBOG, NB-MED, etc. Tous ces documents sont réputés êtr
Comments
In Channel